Comment former et utiliser les superlatifs associés au present perfect en anglais ?
Ta prof de soutien scolaire en ligne te propose ce sujet corrigé de spé physique chimie première pour réussir ton bac E3C : loi Beer-Lambert, ions ferreux, dosage hémoglobine et traitement d’une carence en fer.
Ce cours de physique chimie en ligne niveau lycée (première) porte sur un corrigé complet d'épreuve de bac E3C.
1.1. Une réaction chimique s'est produite car on observe un changement de couleur (passage d’une coloration violette à une coloration jaune.
1.2. ions permanganates sont les oxydants consommés dans les réactifs et les ions
sont les oxydants formés dans les produits.
Les ions sont les réducteurs consommés dans les réactifs et les ions
sont les réducteurs formés dans les produits.
1.3.1.
1.3.2. Oxydation de
Réduction de
Bilan :
1.3.3. Calcul des quantités de matière de chacun des réactifs.
on a donc les réactifs ont bien été introduits dans des proportions stoechiométriques.
1.4.La ligne du programme codant l’information correspondant à une transformation totale est la ligne 20 car la réaction continue tant que 
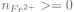
1.5.
Le tableau est compatible car à l'instant initial, on a bien e
.
À l’état final, les réactifs étant totalement consommés car introduits dans des proportions stoechiométriques, on a et
grâce au tableau d’avancement.
1.6. La quantité de matière des ions en fonction de l’avancement est
.
1.7. L’instruction permettant de calculer la quantité de matière de pour une valeur d’avancement x serait :
Elle pourrait être insérée dans le programme après la ligne 24.
1.8.
2.1. Le spectre d'absorption fait apparaître un maximum d'absorbance à une longueur d'onde proche de 550 nm. En se référant au cercle chromatique, on en déduit qu'elle absorbe dans le vert jaune.
La couleur de la solution est la couleur complémentaire de la couleur absorbée, diamétralement opposée sur le cercle chromatique. La couleur de la solution est donc rouge-violet.
2.2. Le choix de la longueur d’onde de mesure d’absorbance correspond à la longueur d’onde la plus fortement absorbée par la solution.
2.3.1. On sait que l'absorbance de l'échantillon est de A = 0,26.
La courbe de l’absorbance en fonction de la concentration permet de déduire que la concentration en hémoglobine est de égale 1,4 mmol/L.
Les taux d’hémoglobine sont donnés en g/L.
On calcule la concentration massique de l'hémoglobine :
Cm = C x M(Hb) = 1,4 ×10 –3 × 64×10 3 = 89,6 g/L (90 g/L).
Le tableau de référence permet de conclure que cette femme a une carence modérée car la concentration massique est comprise en 80 et 110 g/L.
2.3.2. Les recommandations pour le traitement préconise chez la femme un apport quotidien équivalent à 100 mg pour une carence modérée.
Un comprimé contient 136 mg de sulfate ferreux (FeSO4).
On calcule la masse molaire du sulfate ferreux M(FeSO4) = 55,8 + 32 + 4 x 16 = 151,8 g/mol soit 100 %
On calcule la proportion de fer Fe : M(Fe) = 55,8 g/mol soit
Il y a donc mg.
La femme devra donc prendre 2 gélules par jour.
Comment former et utiliser les superlatifs associés au present perfect en anglais ?
Quelle est la différence entre "whether" et "if "?